
杜宇慧个人网页---智能医学图像分析
地址:中国, 太原
研究内容
脑影像分析是实验室最主要的一个研究领域。我们利用脑影像理解疾病相关的脑功能和结构变异,辅助临床诊断和精准识别不同的脑疾病,并基于数据驱动和人工智能方法重新客观定义脑疾病类别。实验室的研究主要分为以下几个方向:
(1) 开发了新的脑功能网络分析方法和软件,并运用于探索精神疾病的脑功能异常
杜宇慧开发了新的稳态和动态脑功能网络分析方法,可以在保证不同被试脑功能网络可比性的同时优化个体特异性以得到准确的脑功能网络,可用于多站点大样本数据的脑功能网络分析。在此方面,杜宇慧以第一作者身份和通讯作者身份发表9篇SCI收录文章,包括Top期刊文章8篇;杜宇慧获专利一项、软件著作权三项;申请专利三项,开发了两个脑功能网络分析软件。部分文章列表如下:
a) Yuhui Du and Yong Fan. Group information guided ICA for fMRI data analysis. NeuroImage, 2013, 69: 157-197.
b) Yuhui Du*, Elena A Allen, et al. Artifact removal in the context of group ICA: a comparison of single-subject and group approaches. Human Brain Mapping, 2016, 37(3), 1005-1025.
c) Yuhui Du*, Dongdong Lin, et al. Comparison of IVA and GIG-ICA in brain functional network estimation using fMRI data. Frontiers in Neuroscience, 2017, 11, 267.
d) Yuhui Du*, Godfrey D Pearlson, et al. Identifying dynamic functional connectivity biomarkers using GIG-ICA: application to schizophrenia, schizoaffective disorder and psychotic bipolar disorder. Human Brain Mapping, 2017, 38(5), 2683-2708.
e) Yuhui Du*, Z. Fu, J. Sui et al. NeuroMark: An automated and adaptive ICA based pipeline to identify reproducible fMRI markers of brain disorders. NeuroImage: Clinical, 2020, 28, 102375.
下面对主要工作内容做介绍:
我们提出“组信息指导独立成分分析” (group information guided ICA,GIG-ICA)方法可用于得到更为准确的稳态脑功能网络。该工作于2013年发表在神经影像算法类top期刊Neuroimage杂志(Du and Fan 2013),该论文已被引用211次。很多研究者在他们自己的工作中使用该算法提取网络特征得到了较高的疾病分类准确率(Salman, Du et al. 2017, Kam, Zhang et al. 2018, Osuch, Gao et al. 2018)。另外,本工作2011年获得OHBM大会颁发的“Trainee Abstract Travel Award”奖项。该方法也被集成到神经影像领域广泛使用的GIFT软件中,成为组独立成分分析三大算法之一。“组信息指导独立成分分析”是基于多目标函数优化框架同时优化个体被试成分和组独立成分之间的对应性以及个体被试多个成分之间的独立性,可得到更为准确的个体被试脑功能网络。该方法的优点是:(1)相对于经典的反重建(back-reconstruction)方法和双线性回归(dual regression)方法,该方法得到的成分具有更强的独立性和对应性,得到的独立成分和时间序列更准确,且该方法对使用的成分个数更加鲁棒;(2)优于传统的反重建方法,该方法适用于新的独立数据的分析,使得新的测试数据和已有训练数据的脑网络特征可以比较,有利于分类目的和可靠性验证;(3)该方法还可以将由其它先验知识得到的脑网络模板作为参考信号计算个体被试的脑功能网络,有利于分析结果的无偏性。此外,我们利用大量的模拟数据和真实fMRI数据比较了GIG-ICA方法和独立分量分析方法(Independent Vector Analysis),结果表明GIG-ICA也优于独立分量分析方法,该工作发表于Frontiers in NeuroScience杂志(Du, Lin et al. 2017)。此外,我们还提出新的fMRI数据去噪方法,该方法较已有的基于个体被试去噪可得到更为准确的结果。该工作于2016年发表在神经影像算法类top期刊、一区杂志Human Brain Mapping杂志(Du, Allen et al. 2016) 和2014年EMBC会议(Du, Allen et al. 2014)。为了克服已有基于分解的方法无法从动态脑功能网络中估计个体被试的功能连接状态这一缺陷,我们还提出新的动态脑功能网络分析方法,已发表于一区top期刊Human Brain Mapping杂志(Du, Pearlson et al. 2017)。此外,我们提出了一种新的估计大脑功能网络测度的分析方法NeuroMark,并于2020年发表于NeuroImage: Clinical(Du, Fu et al. 2020)。我们开发的脑影像分析软件已发布于脑影像领域著名的NITRC平台(http://www.nitrc.org/projects/gig-ica/),软件界面如图1-1。软件可对脑功能数据进行ICA提取个体的脑功能网络并进行显示,主要包括功能为:组水平独立成分计算、个体水平独立成分计算(包括组信息指导独立成分分析、反重建方法三种实现、以及双线性回归方法)、参数控制(包括PCA降维维数、ICA算法、ICA成分个数等)、以及脑功能网络显示。此外,基于提出的脑功能网络分析方法NeuroMark,我们开发并在网站上发布了相应的工具箱(http://www.yuhuidu.com),工具箱主界面如图1-2。该软件可以根据特定的大脑网络模板估计出被试对应的成分和时间序列,并将其可视化展示。
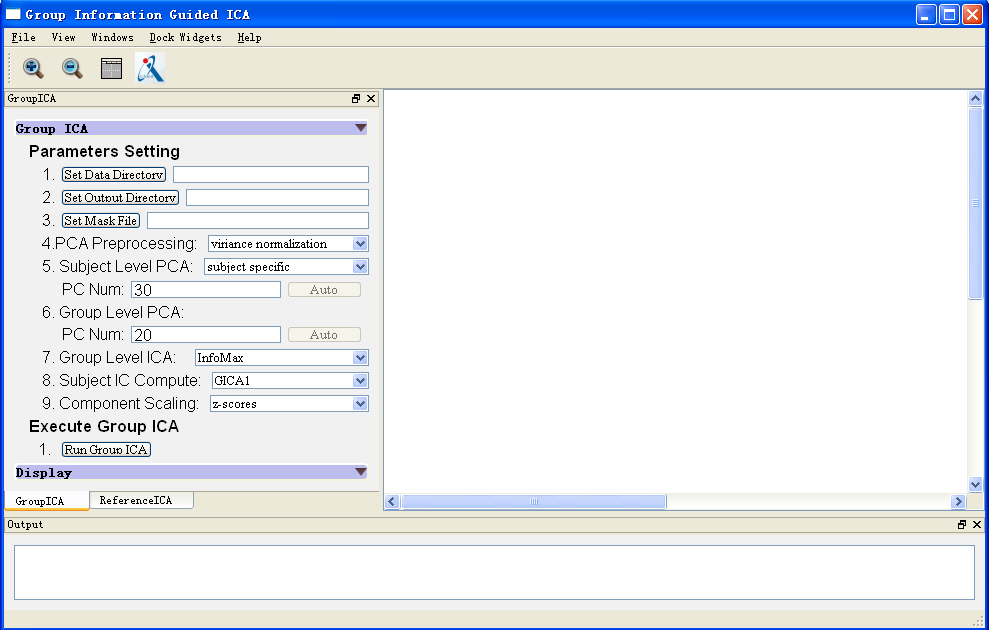
图1-1 开发的脑功能网络分析软件界面
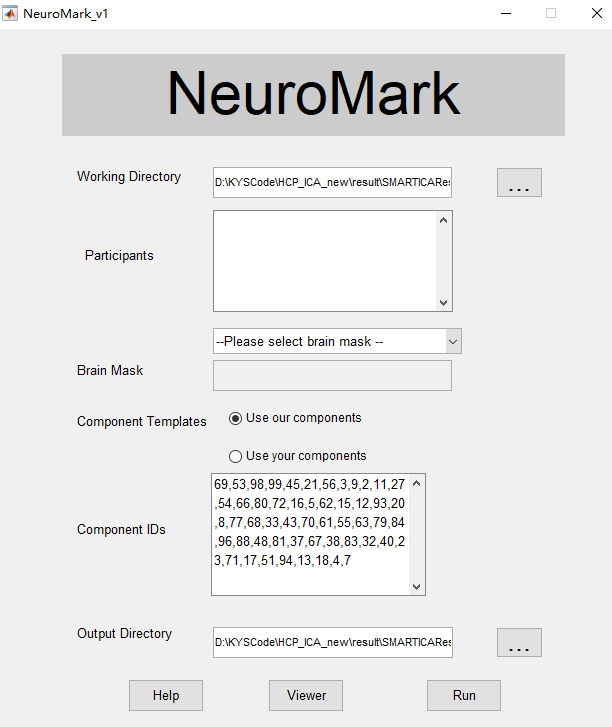
图1-2 开发的NeuroMark脑功能网络分析工具包主界面
(2) 基于多模态影像发掘精神疾病的生物影像标志
杜宇慧基于多模态脑影像对多种精神疾病的生物影像标志进行了探索,这些精神疾病涵盖了精神分裂症、自闭症谱系障碍、双相情感障碍、抑郁症、老年痴呆等,使用的多模态影像特征包括来由脑功能核磁共振数据估计的多尺度脑功能连接、功能网络内连通性、功能局部一致性和时频特性等,由脑结构磁共振数据估计的脑灰质密度和体积等,以及由脑电和弥散磁共振数据得到的多种测度。关于这方面的工作,杜宇慧以第一作者身份和通讯作者身份发表10篇SCI收录文章,包括Top期刊文章8篇。部分文章列表如下:
a) Yuhui Du*, Godfrey D. Pearlson, et al. Interaction among subsystems within default mode network diminished in schizophrenia patients: A dynamic connectivity approach. Schizophrenia Research, 2016, 170(1): 55-65.
b) Yuhui Du*, Susanna L Fryer, et al. Dynamic functional connectivity impairments in early schizophrenia and clinical high-risk for psychosis. Neuroimage, 2018, 632-645.
c) Yuhui Du*, et al. Identifying functional network changing patterns in individuals at clinical high-risk for psychosis and patients with early illness schizophrenia: A group ICA study. Neuroimage: Clinical, 2018, 17: 335-346.
d) Yuhui Du*, Zening Fu, Vince D Calhoun. Classification and Prediction of Brain Disorders using Functional Connectivity: Promising but Challenging. Frontiers in Neuroscience, 2018, 12, 525.
e) Mustafa S Salman, Yuhui Du*, et al.. Group ICA for Identifying Biomarkers in Schizophrenia: ‘Adaptive’ Networks via Spatially Constrained ICA Show More Sensitivity to Group Differences than Spatio-temporal Regression. NeuroImage Clinical, 2019.
f) Yuhui Du*, Hui Hao, Shuhua Wang, Godfrey D Pearlson, Vince D. Calhoun. Identifying commonality and specificity across psychosis sub-groups via classification based on features from dynamic connectivity analysis. NeuroImage: Clinical, 2020, 27: 102284.
g) Yuhui Du*, Zening Fu, et al. Evidence of shared and distinct functional and structural brain signatures in schizophrenia and autism spectrum disorder. Communications biology, 2021, 4(1): 1-16.
下面对主要内容做介绍:
我们还基于独立成分分析方法分析精神分裂症的变异,该工作于2018年发表在NeuroImage:Clincal杂志(Du, L. et al. 2018),该杂志为影响因子4.3的二区杂志,属于医学影像类很有潜力的杂志。大多数已有的同时探索高风险精神分裂症和精神分裂症的相关研究是基于先验脑区研究脑功能连接。基于70个正常被试,53个高风险精神分裂症患者和58个精神分裂症患者的静息态状态下的功能核磁共振数据, 该研究利用独立成分分析方法提取每个个体被试的脑功能网络,并利用统计分析方法分析患者的变异,然后将脑功能上的变异与临床诊断指标求解相关性。
在动态脑功能网络方向,我们做出了一定成绩,受到了许多国内外专家的关注。我们使用动态脑功能网络研究具有精神分裂症先兆症状的个体被试,相关工作发表于2018年NeuroImage (Du, Fryer et al. 2018)杂志,并获得2016年OHBM大会颁发的“Trainee Abstract Travel Award”奖项,该论文已被引用89次。我们采用动态脑功能网络分析精神分裂症患者默认模式网络变异的另一工作(Du, Pearlson et al. 2016)于2016年发表在Schizophrenia Research杂志(影响因子:4.45),该论文已被引用143次。大量的高水平文章引用了我们在动态脑功能网络研究方面的成果,这些文章包括发表于NeuroImage的“The dynamic functional connectome: State-of-the-art and perspectives”、“The energy landscape underpinning module dynamics in the human brain connectome”、“Fast imaging for mapping dynamic networks”、发表于Neuro杂志的 “From Maps to Multi-dimensional Network Mechanisms of Mental Disorders” 等。
(3) 开发新的聚类方法用于探索精神疾病子型
杜宇慧使用脑功能网络测度基于层次聚类方法探索了精神谱系障碍疾病的子型间关系;提出了基于图核的聚类方法对精神分裂症和自闭症谱系障碍进行重新分组,以探索跨诊断生物型;提出新的超图聚类方法对精神分裂症患者和双相情感障碍患者进行聚类以便从脑影像客观测度区分它们,并提取其生物标志物。关于这方面的工作,杜宇慧以第一作者身份发表3篇论文,1篇为Top期刊文章,2篇为IEEE会议。部分文章列表如下:
a) Yuhui Du*, Godfrey D Pearlson, et al. A group ICA based framework for evaluating resting fMRI markers when disease categories are unclear: application to schizophrenia, bipolar, and schizoaffective disorders. NeuroImage, 2015, 122, 272-280.
b) Yuhui Du*, Ju Niu, Vince D Calhoun. A new hypergraph clustering method for exploring transdiagnostic biotypes in mental illnesses: application to schizophrenia and psychotic bipolar disorder. 2021 IEEE 18th International Symposium on Biomedical Imaging (ISBI). 2021, 971-974.
下面对主要内容做介绍:
我们利用稳态脑功能网络分析方法发掘神经分裂症、双相情感障碍、分裂性情感障碍在脑功能网络上的异常,该工作于2015年发表于Neuroimage杂志(Du, Pearlson et al. 2015),已被引用103次。本工作分析了美国Olin Neuropsychiatric Research Center采集到20名正常被试(HC)、20名精神分裂症患者(SZ)、20名双相情感障碍患者(BP)、20名分裂情感性障碍双相型患者(SADM)、13名分裂情感性障碍抑郁型患者(SADD)的静息态fMRI数据。我们首先基于所有被试预处理后的fMRI数据采用“组信息指导独立成分分析”方法提取个体被试的脑功能网络。其次,对每个脑功能网络执行基于体素的单样本t检验得到统计重要区域,基于这些区域使用协方差分析(ANCOVA)及机器学习方法得到组差异重要区域。然后,基于组差异重要区域提取每个被试的特征向量,采用t-SNE投影方法和三种聚类方法考察不同组间脑功能网络关系。最后,基于发现的组差异重要区域和训练好的分类器,对16个新的疾病患者数据进行分类。

 您当前的位置:
您当前的位置: